Зміст
За найпростішим визначенням оксиди — це хімічні сполуки, утворені атомами Оксигену та атомів певних елементів.
Оксиди — надзвичайно поширені в природі речовини крем, тобто оксид кремнію, становить майже чверть маси земної мантії.
Зустрічаються в повітрі – оксиди вуглецю, оксиди сірки; у формі твердих тіл, будуючи багато мінералів і гірських порід. Вони просто скрізь.
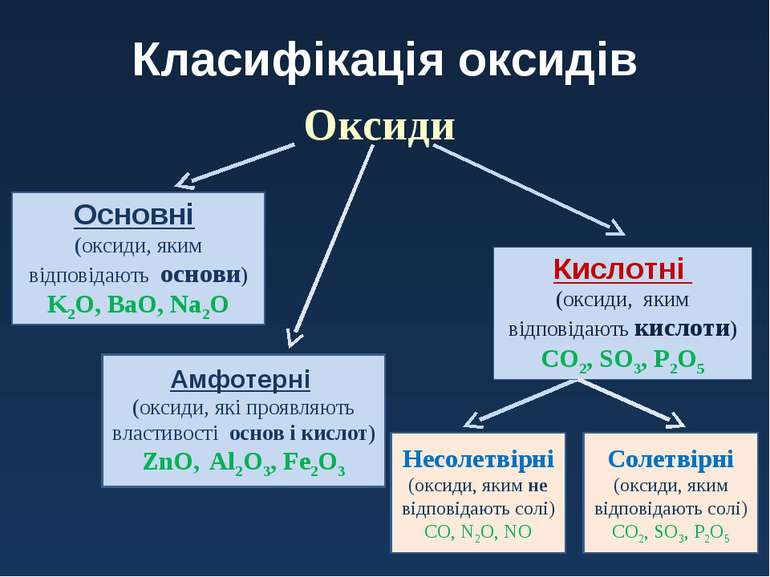
- Поділ оксидів за їх хімічною природою.
Через величезну різноманітність оксидів не всі вони виявляють однакові хімічні властивості. Для того щоб можна було розглянути і визначити їх поведінку по відношенню до інших речовин, реакційну здатність і фізичні властивості, їх слід розділити на кілька груп.
- Основні оксиди
Основні оксиди — це оксиди, які реагують з кислотами, але стійкі до лугів.
Реакція основного оксиду з кислотою утворює сіль.
Наприклад, MgO + H 2 SO 4 → MgSO 4 + H 2 O
MgO + NaOH → не зустрічається
K 2 O + H 2 CO 3 → K 2 CO 3 + H 2 O
K 2 O + Mg(OH) 2 → не зустрічається
Основні оксиди часто називають основними ангідридами, оскільки більшість із них (оксиди лужних і лужноземельних металів) розчиняються у воді з утворенням основ (гідроксидів основних металів).
Хімічна реакція такого розчину лужна.
Наприклад, Na 2 O + H 2 O → 2 NaOH
CaO + H 2 O → Ca(OH) 2
До основних оксидів відносяться всі оксиди лужних металів (Li 2 O, Na 2 O, K 2 O, Rb 2 O, Cs 2 O), оксиди лужних металів, за винятком оксиду берилію (MgO, CaO, SrO, BaO) і деяких металів. оксиди d (наприклад, CrO, MnO, HgO, NiO, Ni 2 O 3 , Co 2 O 3 ).
- Кислотні оксиди
Кислотні оксиди — це оксиди, які реагують з основами, але стійкі до дії кислот.
У результаті взаємодії кислотного оксиду з основою утворюється сіль.
Наприклад, SO 2 + 2 NaOH → Na 2 SO 3 + H 2 O
SO 2 + HCl → не зустрічається
CO 2 + 2 KOH → K 2 CO 3 + H 2 O
CO 2 + H 2 SO 4 → не зустрічається
Кислотні оксиди часто називають ангідридами кислот, тому що переважна більшість з них (крім SiO 2 ) розчиняються у воді, утворюючи кисневі кислоти.
Хімічна реакція такого розчину кисла.
Наприклад, SO 3 + H 2 O → H 2 SO 4
N 2 O 3 + H 2 O → 2 HNO 2
Кислотні оксиди включають, серед інших: CO 2 – оксид вуглецю (IV), SO 2 – оксид сірки (IV), SO 3 – оксид сірки (VI), N 2 O 3 – оксид азоту (III), N 2 O 5 – азоту оксид (V), P 2 O 5 – фосфору (V) оксид, P 2 O 3 – фосфору (III) оксид, As 2 O 5 – миш’яку (V) оксид і всі оксиди хлору, брому і йоду. На додаток до згаданих вище, також деякі оксиди d-блоку металів у своїй найвищій валентності демонструють характеристики кислотних оксидів, наприклад: Mn 2 O 7– манган (VII) оксид, CrO 3 – хром (VI) оксид.
- Амфотерні оксиди
Амфотерні оксиди — це оксиди, які реагують як з кислотами, так і з основами.
Реакція амфотерного оксиду з кислотою дає сіль, тоді як реакція з основою утворює сольову координаційну сполуку.
Наприклад, Al 2 O 3 + 6 HCl → 2 AlCl 3 + 3 H 2 O
Al 2 O 3 + 6 NaOH + 3 H 2 O → 2 Na 3 [Al(OH) 6 ]
CuO + H 2 SO 4 → CuSO 4 + H 2 O
CuO + H 2 O + 2 KOH → K 2 [Cu(OH) 4 ]
Амфотерні оксиди, як правило, нерозчинні у воді і легко випадають з водних розчинів у вигляді осаду. З цієї причини їх хімічна реакція нейтральна.
До найважливіших амфотерних оксидів належать: Al 2 O 3 – оксид алюмінію, CuO – оксид міді (II), Cu 2 O – оксид міді (I), ZnO – оксид цинку, MnO 2 – оксид марганцю (IV), Cr 2 O 3 – хром (III) оксид, FeO – заліза (II) оксид, Fe 2 O 3 – заліза (III) оксид , As 2 O 3 – миш’яку (III) оксид, оксиди свинцю (PbO і PbO 2 ), оксиди олова ( SnO і SnO 2 ) і оксиди сурми (Sb 2 O 3 і Sb 2 O 5 ).
- Інертні оксиди
Нейтральні оксиди — це оксиди, які не реагують ні з кислотами, ні з основами.
Вони не утворюють солей, не є ні кислотними, ні основними ангідридами.
Наприклад, NO + HCl → не зустрічається
NO + NaOH → не зустрічається
Зазвичай ці оксиди не розчиняються у воді, а якщо і розчиняються, то тільки фізично. Вони не реагують з водою.
Наприклад, CO + H 2 O → не зустрічається
Лише деякі сполуки належать до групи нейтральних оксидів. Вони можуть обмінюватися: NO – оксид азоту (II), CO – оксид вуглецю (II), N 2 O – оксид азоту (I).
- Поділ оксидів за типом елемента, що входить до складу оксиду
Окрім згаданого вище поділу на кислотні, основні, амфотерні та нейтральні оксиди, їх також можна розділити на оксиди металів і оксиди неметалів.
- Оксиди металів
Оксиди неметалів — сполуки металу з киснем.
Як правило, це тверді речовини з високими температурами фазового переходу. Їхні молекули характеризуються іонною або полярною будовою. Більшість оксидів металів реагують з водою з утворенням гідроксидів (часто лише при підвищених температурах). Зазвичай вони мають лужну або амфотерну природу, деякі з них можуть бути кислотними.
- Оксиди неметалів
Оксиди неметалів — сполуки неметалла з киснем
Вони можуть існувати в різних агрегатних станах, хоча зазвичай є газами або рідинами. Для них характерні відносно низькі температури фазових переходів. Їхні молекули сильно поляризовані. Більшість оксидів неметалів реагують з водою з утворенням кислот. Найчастіше вони мають кислотний або нейтральний хімічний характер, рідше амфотерні.
- Номенклатура оксидів
В даний час використовуються дві системи найменування оксидів, перша – це систематична і рекомендована номенклатура, а друга – більш звичайна, але все ж дозволена номенклатура.
- Фондова система
Ця система заснована на визначенні валентності елементів, що утворюють дану сполуку. У випадку оксидів спочатку вживається термін оксид, а потім назва елемента в родовому відмінку. Наприкінці в круглих дужках римськими цифрами подається валентність цього елемента в даному оксиді. Якщо даний елемент утворює сполуки тільки в одному ступені окиснення (однієї валентності), то цю валентність слід опускати.
Наприклад, PbO – свинцю (II) оксид
PbO 2 – свинцю (IV) оксид
Al 2 O 3 – оксид алюмінію
MgO – оксид магнію
- Префіксальна система
Ця система заснована на записі хімічної формули даної сполуки, а точніше на стехіометричних показниках. Якщо в даній молекулі два однакових атома, то перед назвою слід додати префікс ди- або ди-, якщо три – три- або три- і т. д. Для одиничних атомів у молекулі префікси не використовуються. додано.
Наприклад, СО – чадний газ
CO 2 – діоксид вуглецю (вуглекислий газ)
Al 2 O 3 – діалюміній триоксид
- Раніше використовувалася система імен, заснована на закінченнях -owy (для оксидів з найвищою валентністю) і -awy (для оксидів з нижчою валентністю). Зараз така номенклатура не рекомендована, вона поступово виходить із польської номенклатури хімічних сполук.
Наприклад, SO 2 – сірчистий оксид
SO 3 – оксид сірки
- Хімічні зв’язки в молекулах оксидів
Тип хімічного зв’язку між атомом кисню та атомом елемента залежить від різниці електронегативності між ними. Оксиди лужних металів, лужноземельних металів і боролів (крім бору) мають іонну структуру, оскільки елементи, що належать до цих груп, мають низьке значення електронегативності, виражене за шкалою Полінга (від 0,7 для цезію до 1,5 для алюмінію). У випадку решти елементів можна побачити збільшення ковалентності їх оксидів. З цього випливає, що загалом неметалічні оксиди мають полярну молекулярну структуру.
- Отримання оксидів
Нижче наведено кілька загальних методів отримання оксидів. Однак слід пам’ятати, що не всі оксиди можна отримати кожним методом. Якщо ви хочете отримати конкретний оксид, вам потрібно знайти найкращий, індивідуальний метод у літературі.
- Термічний розклад солей і гідроксидів металів
Наприклад, CaSO3 → CaO + SO2
Mg(OH) 2 → MgO + H 2 )
- Відновлення оксидів – з оксиду елемента з більшою валентністю отримуємо оксид елемента з меншою валентністю.
Наприклад, PbO2 + H2 → PbO + H2O
2 MnO 2 + H 2 → Mn 2 O 3 + H 2 O
- Окислення оксидів – – оксид елемента з нижчою валентністю перетворюється на оксид елемента з вищою валентністю.
Наприклад, 2 CO + O 2 → 2 CO 2
2 SO 2 + O 2 → 2 SO 3
- Прямий синтез з елементів – т. зв реакція горіння
Наприклад, C + O 2 → CO 2
2 Ca + O 2 → 2 CaO
Оксид магнію – що це? Функціонування та застосування
Оксид магнію містить велику кількість Mg, елемента фундаментального значення для стану організму. У дієтичних добавках він працює ідеально, особливо у розширеній формулі, у поєднанні з іншими формами магнію та лимонною кислотою.

КОРОТКО
Оксид магнію є однією з найбільш часто використовуваних форм цього елемента в дієтичних добавках.
Властивості оксиду магнію дозволяють закрити велику кількість Mg в одній таблетці.
MgO добре переноситься організмом людини, а в поєднанні з іншими інгредієнтами виділяється збалансовано, забезпечуючи тривале підвищення концентрації магнію в крові.
Що таке оксид магнію?
Оксид магнію є однією з форм, у якій цей ключовий для здоров’я людини елемент міститься в дієтичних добавках. Її ще називають паленої магнезією. З хімічної точки зору це сполука з групи основних оксидів. Містить магній у другому ступені окислення.
Його формула MgO. У природі зустрічається як мінерал периклаз, але в такому вигляді зустрічається дуже рідко. Для промислового та медичного застосування його отримують у процесі спалювання магнію або випалу карбонату магнію.
Оксиди магнію використовуються в добавках через те, що цей елемент, будучи металом, не можна приймати в чистому вигляді.
Звідси виникає необхідність з’єднання його з іншими речовинами в неорганічні та органічні сполуки – оксиди , гідроксиди, карбонати, цитрати, таурати, глікани та багато інших.
Властивості та дія магній оксиду

Властивості оксиду магнію в контексті здоров’я людини добре відомі і в основному пов’язані з дією самого Mg.
Він необхідний для правильної мінералізації кісток, бере участь у процесах скорочення і розслаблення м’язів, розширює кровоносні судини, бере участь у синтезі білків, жирів і нуклеїнових кислот, стабілізує молекули АТФ, які є носіями енергії в організмі людини.
Оксид магнію добре розчиняється в кислотах, тому вдало з ними поєднується. Це не шкідливо жодним чином , за винятком ситуацій, коли значне передозування відбувається в результаті недотримання рекомендацій щодо добавок.
Застосування оксиду магнію
Палений магній використовується в багатьох галузях промисловості, включаючи виробництво цементу або лиття. Він також використовується як нейтралізатор для фотоемульсії.
Однак перш за все оксид магнію використовується в медицині , будучи частиною препаратів для поповнення дефіциту цього елемента, одного з найважливіших, коли мова йде про правильне функціонування людського організму. Варто відзначити, що препарати з оксидом магнію є одними з найпопулярніших на ринку.
Прийом оксиду магнію відповідно до рекомендацій, особливо в комбінації з іншими формами (такими як гідроксид) і органічними кислотами (такими як лимонна):
- підтримує правильне функціонування м’язів,
- покращує роботу нервової системи,
- зменшує відчуття втоми і втоми,
- підвищує когнітивні здібності (пам’ять, концентрацію, навчання).
Біодоступність оксиду магнію
Яка біодоступність оксиду магнію? Численні дослідження показують, що це близько 4 відсотків. і є типовим для неорганічних форм, у яких зустрічається цей елемент.
Варто звернути увагу на додаткові речовини, які входять до складу конкретних препаратів і впливають на засвоєння оксиду та інші властивості. Хорошим прикладом є згадана вище лимонна кислота. Ця речовина:
- підкислює середовище травної системи,
- забезпечує кращу розчинність магнію в шлунку і кишечнику,
- підтримує процес поступового вивільнення магнію оптимальним для організму способом.
Важливо відзначити, що лимонна кислота є тією ж сполукою, що міститься в цитраті магнію (де вона зв’язується з іонами Mg).
Що краще оксид магнію або цитрат магнію? Друге з цих речовин краще засвоюється, але оксид зазвичай краще переноситься організмом. Магній у формулі оксиду також дозволяє використовувати більшу кількість цього інгредієнта в добавках.
Завдяки цьому MgO можна успішно використовувати для заповнення навіть великих недоліків.
Не без значення також нижчі витрати на виробництво добавок оксиду магнію, що перетворюється на ціну покупки пацієнтом.
Чи ефективний оксид магнію? Так, і це пов’язано не тільки з великою кількістю Mg в препаратах, але і з його властивостями.
В останні роки з’явилися результати досліджень, які вказують, наприклад, на вищу ефективність оксиду, порівняно з цитратом, у покращенні параметрів загального холестерину та т.зв. зло, тобто фракція LDL (М. Шехтер).
Інші автори повідомляють, що препарати, що містять MgO, а також гідроксид магнію Mg(OH)2 корисні для здоров’я, оскільки після їх застосування спостерігається повільне, але стійке і тривале підвищення концентрації Mg в сироватці крові.
Вони також позитивно впливають на збільшення щільності кісткової тканини (М. Іскра).