Зміст
Важливим розділом органічної хімії є ізомерія.
Ізомери – це хімічні сполуки, що мають однакову молекулярну формулу, але відрізняються один від одного структурними формулами. Кількість можливих ізомерів настільки велика, що це вимагає написання структурних чи напівструктурних формул органічних сполук. Будова окремих ізомерів впливає на їх властивості, наприклад, на температуру кипіння або розчинність.
Конституційна ізомерія
Найпоширеніша ізомерія в органічній хімії називається конституційною ізомерією. Вона включає з’єднання, що відрізняються один від одного положенням зв’язків у ланцюзі або кільці, а також розташуванням функціональних груп у скелеті.
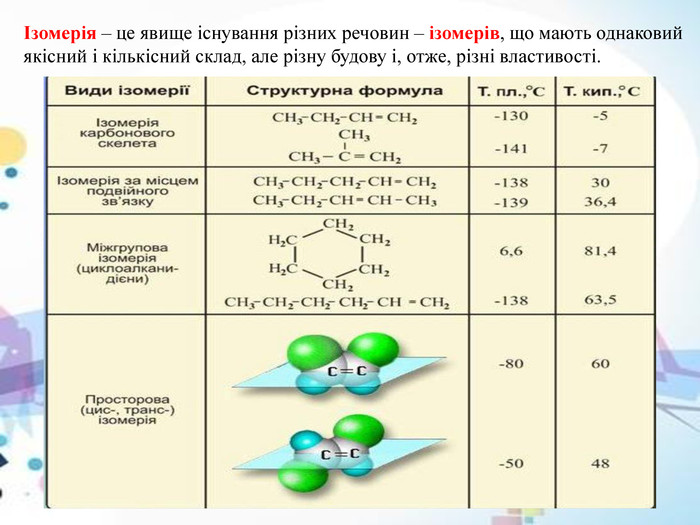
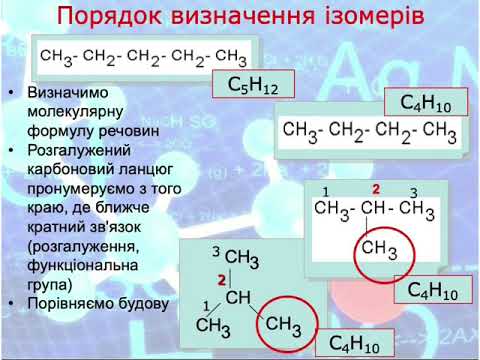
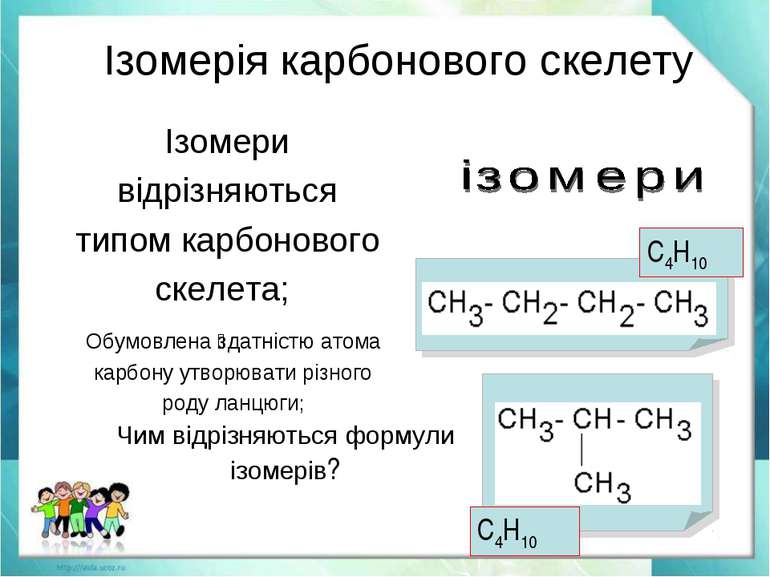
Ізомерія вуглецевого скелета – ланцюгова
Цей тип ізомерії характерний насамперед для аліфатичних вуглеводнів. Ланцюгова ізомерія пов’язана із зміною довжини вуглецевого ланцюга, а також кількості замісників. Вона характерна для алканів. З цієї причини в органічній хімії існують молекули з прямим і розгалуженим ланцюгом. У міру збільшення довжини ланцюга, тобто збільшення числа атомів вуглецю, з яких він побудований, збільшується кількість ізомерів ланцюга для даної сполуки. Так пропан має два ізомери, а гептан уже дев’ять. Кількість ізомерів даних молекул змінюється нерівномірно, і вивести конкретну формулу цієї залежності неможливо.
Ланцюгова ізомерія має важливе значення, коли йдеться про властивості органічних сполук. Крім іншого, спостерігаються різні значення температури кипіння ізомерів (розгалужені ізомери більш леткі) або зміна інтенсивності сил Ван-дер-Ваальса (лінійні молекули набагато щільніше прилягають одна до одної і через це сильніші короткодіючі сили).
Ізомерія положення заступника чи кратного зв’язку
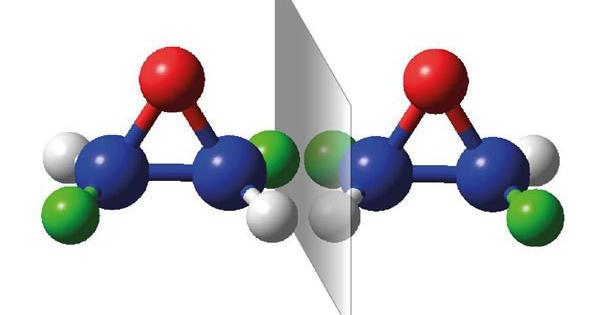
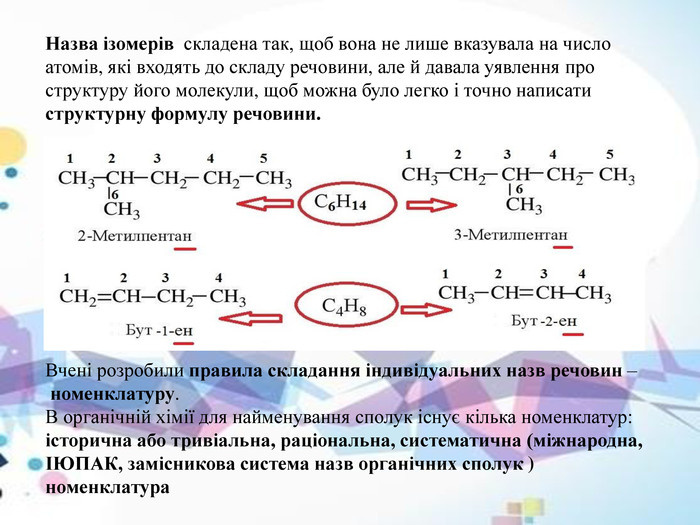
Заступник або функціональна група можуть бути в різних місцях молекули, тобто можуть бути приєднані до різних атомів вуглецю в ланцюзі органічної сполуки. Привласнюючи назву з’єднанню, необхідно вказати положення зазначеного заступника, замінюючи номер атома вуглецю, до якого він був приєднаний.
Аналогічна ситуація виникає у разі сполук, що містять кратні зв’язки, подвійні (наприклад, алкени ) або потрійні (наприклад, алкіни ). Ізомерія положення кратного зв’язку в органічних сполуках полягає в тому, що вона може виникати між різними атомами вуглецю в ланцюзі. Називаючи такі ізомери, необхідно вказувати номер атома вуглецю, з яким виникає кратний зв’язок.
Ізомерія функціональної групи
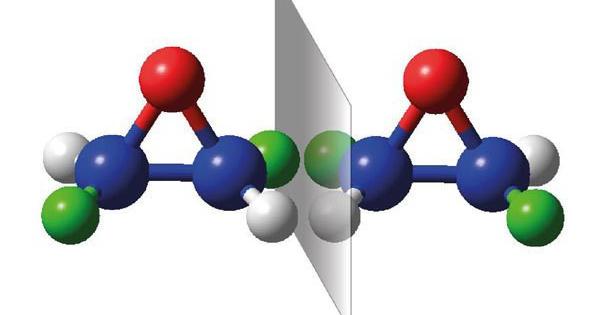
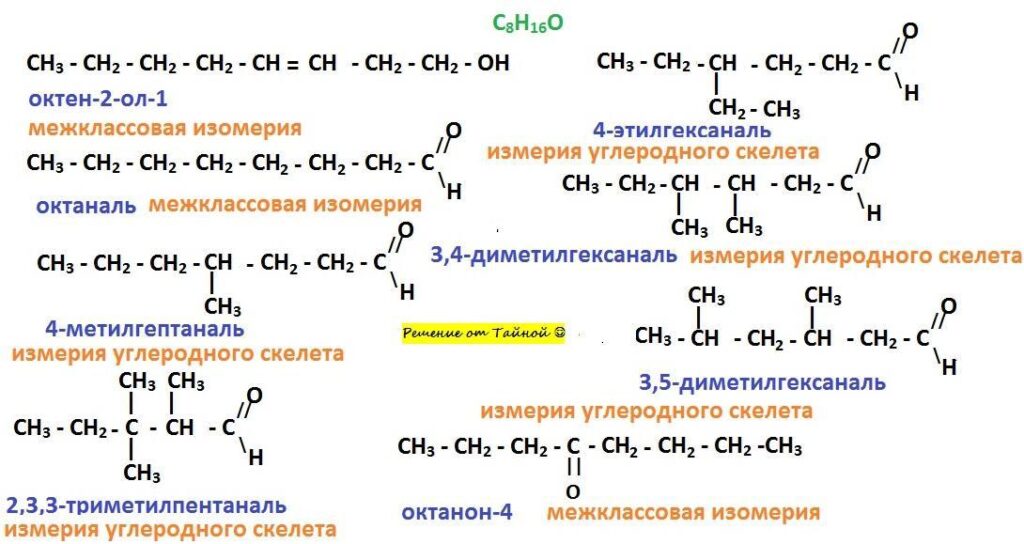
Даний тип ізомерії зустрічається у сполук з однаковою молекулярною формулою, що утворюють різні функціональні групи. В основному вона зустрічається в кетонах, альдегідах, ефірах насичених карбонових кислот та насичених аліфатичних карбонових кислот. Наприклад, ізомерами на основі функціональних груп є пропан-2-он (кетон) та пропаналь (альдегід).
Стереоізомерія
Стереоізомерами називаються ізомери, що відрізняються один від одного просторовим розташуванням атомів.
Цис-транс ізомерію
Цей тип ізомерії характерний для ненасичених органічних сполук, що мають у своєму складі подвійний зв’язок, наприклад, алкенів. Цис-транс ізомерію ґрунтується на різному розташуванні замісників щодо подвійного зв’язку або площини кільця в кільцевих з’єднаннях. Вона типова для молекул, у яких немає можливості обертання навколо цього зв’язку (жорсткий елемент з’єднання). Крім того, на кожному атомі вуглецю, який утворює подвійний зв’язок, повинні бути дві неідентичні групи. Якщо в молекулі є чотири різних заступники, то для неї неможливо визначити ізомерію цис-транс ізомерію. Для вказівки типу існуючої в молекулі ізомерії використовуються префікси цис- або транс-які ставляться перед хімічною назвою сполуки. Цисізомери характеризуються тим, що навколо ненасиченого зв’язку або кільця однакові заступники розташовуються з одного боку. Зворотна ситуація має місце у транс -ізомерах, де заступники розташовані на протилежних сторонах. Цей тип ізомерії також має місце у разі циклоалканів, тобто сполук, побудованих з насиченого вуглеводневого ланцюга, що утворює кільце.
Цис-транс -ізомери певної сполуки зазвичай відрізняються фізико-хімічними властивостями. Це відбувається через різну відстань між атомами. Заступники в положенні ци- знаходяться набагато ближче один до одного, ніж у положенні транс-.
Енантіомерія та діастереоізомерія
Хіральність молекул одна із найважливіших понять органічної хімії. Хіральні атоми вуглецю – це такі атоми, які пов’язані з чотирма різними заступниками. Якщо дана хімічна сполука має один хіральний атом, вона потім утворює дві пари молекул, так звані енантіомери. Вони характеризуються тим, що виглядають як дзеркальне відображення одне одного, але не перекривають одне одного. Це зумовлено тим, що зв’язки навколо хірального атома розташовані тетраедрично.
Характерною особливістю енантіомерів є їхня здатність обертати площину поляризованого світла. Якщо один з них обертає площину світла на певний кут ліворуч, то інший з пари обертає вправо також на ту ж величину кута. Рацемічна суміш – це така суміш, яка містить рівну кількість обох енантіомерів і тому не має здатності до обертання. Явище обертання поляризованого світла використовують у поляриметрії. Це дозволяє вимірювати концентрацію оптично активної речовини у випробуваному зразку, залежно від величини кута повороту площини поляризованого світла.
Діастереоізомерами називаються молекули, які належать до групи просторових ізомерів, але не є енантіомерами щодо один одного. Іншими словами, це стереоізомери, які не є енантіомерами. Зазвичай, це сполуки, що містять більше одного асиметричного атома вуглецю. Окремі діастереоізомери цієї молекули органічної сполуки відрізняються своїми фізико-хімічними властивостями через наявність різних міжатомних відстаней.
Види ізомерії
Для алкенів характерна як структурна, і геометрична ( цис-транс -) изомерия (рис. 2) .
Загальна формула C n H 2 n відповідає і алкенам і циклоалканам. Отже, алкени та циклоалкани є міжкласовими ізомерами. Структурна ізомерія алкенів обумовлюється також різною будовою вуглецевого скелета молекули ( ізомерія вуглецевого скелета ) та різним становищем подвійного зв’язку у вуглецевому ланцюзі ( ізомерія положення подвійного зв’язку ).
Малюнок 2. Види ізомерії алкенів.
Просторова, або цис-транс -ізомерія алкенів обумовлена різним положенням замісників щодо площини подвійного зв’язку.
Цей вид ізомерії проявляється тоді, коли кожен із атомів вуглецю при зв’язку С=З пов’язані з двома різними заступниками (атомами чи групами атомів).
Той ізомер, у якого однакові замісники при різних атомах вуглецю (ними можуть вважатися і атоми водню) виявляються розташованими по одну сторону площини подвійного зв’язку, називається цис- ізомером (від латинського cis – по цей бік):
Той ізомер, у якого заступники виявляються розташованими з різних боків площини подвійного зв’язку, називається транс -ізомером (від латинського trans – через):
Зазначимо, що оскільки навколо подвійного зв’язку С=С вільне обертання неможливе, цис- і транс -ізомери не можуть у звичайних умовах переходити один в одного. Таке перетворення вимагає розриву π-зв’язку і може відбуватися тільки при повідомленні молекули достатньої кількості енергії, наприклад, при нагріванні або висвітленні. Тому цис- і транс -ізомери являють собою різні індивідуальні речовини, які мають відмінності за фізичними, а іноді і за хімічними властивостями (порівняйте властивості цис -бутену-2 і транс -бутену-2, наведені в табл. 1).
Алкени, у яких хоча б один з атомів вуглецю при подвійному зв’язку з’єднаний з двома однаковими замісниками, не мають цис- та транс- ізомерів. Наприклад, геометрична ізомерія неможлива для бутена-1 і 2-метилпропену:
Хімічні властивості алкенів
Завдяки присутності подвійного зв’язку алкени набагато хімічніше активніші, ніж алкани. Саме подвійний зв’язок є реакційним центром молекул. Для алкенів найбільш характерні реакції приєднання , окислення та полімеризації .
Реакції приєднання
Гідрування
Приєднання водню (гідрування) алкенів протікає у присутності металевих каталізаторів (нікель, платина, паладій) і призводить до утворення алканів:
При використанні активніших, ніж нікель, каталізаторів – платини або паладію – реакція гідрування може протікати і без нагрівання.
ГАЛОГЕНУВАННЯ
Приєднання хлору, брому, йоду (галогенування) алкенів протікає у звичайних умовах. Продуктами реакцій є дигалогензаміщені алкани:
Зазвичай щодо бромування алкенів використовують розчин брому у питній воді – бромну воду. У ході реакції оранжево-буре забарвлення, характерне для бромної води, зникає, відбувається її знебарвлення. Ця реакція є якісною на ненасичені вуглеводні, у тому числі на алкени.
Галогенування, а також гідрогалогенування та гідратація алкенів протікають по іонному механізму з утворенням як проміжну частинку карбокатіону ( можна дати додаток 1 ).
ГІДРОГАЛОГЕНУВАННЯ
При взаємодії алкенів з галогеноводородами (хлороводнем, бромоводнем) утворюються галогензаміщені алкани:
При приєднанні галогеноводородів до несиметричних алкенів виконується правило Марковникова: атом водню переважно приєднується до більш гідрованого атома вуглецю при подвійному зв’язку.
Так, основним продуктом реакції пропілену з бромоводнем є 2-бромпропан (1-бромпропан утворюється лише в незначних кількостях):
Наведемо ще один приклад реакції гідрогалогенування, що протікає за правилом Марковникова:
Важливо розуміти, що правило Марковнікова не універсально: воно застосовується тільки в тому випадку, якщо молекула алкену не містить ніяких більш негативних, ніж вуглець, атомів, а реакція приєднання протікає за іонним механізмом (можна дати додаток 2 про звернення правила Марковнікова ) .
ГІДРАТАЦІЯ
Приєднання води до алкенів – гідратація – протікає в присутності розведених сірчаної або фосфорної кислот і призводить до утворення спиртів. Ця реакція також протікає відповідно до правила Марковнікова:
Хімічні властивості та ізомери гексану
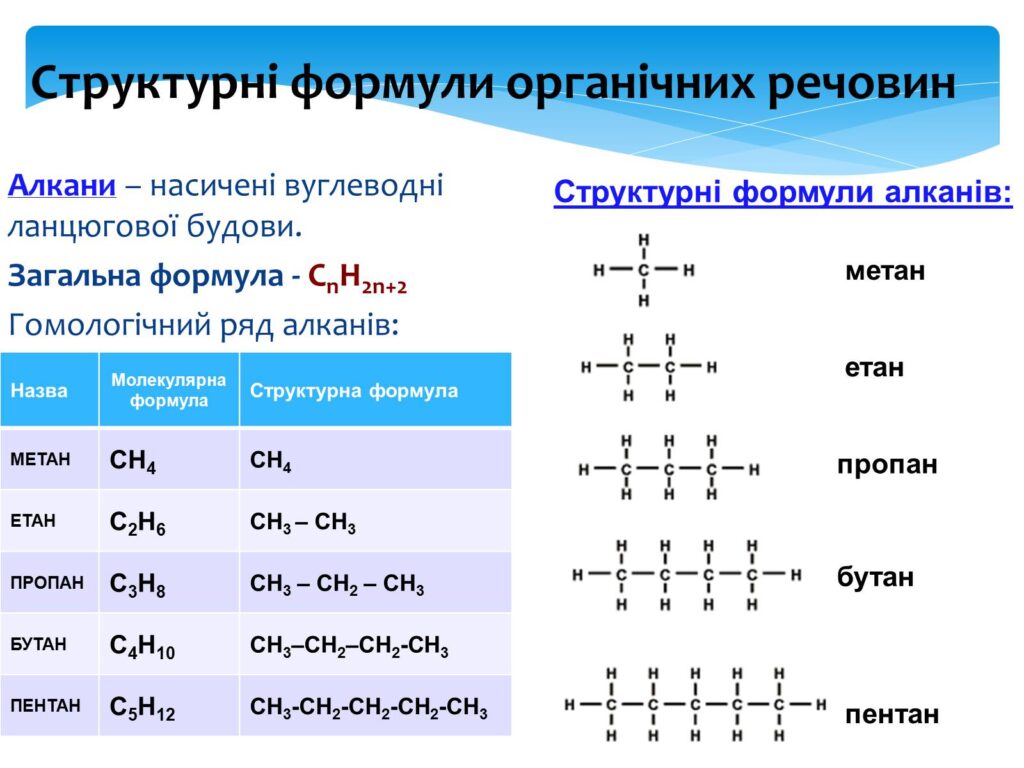
Клас алканів, до яких належить гексан (насичений вуглеводень із формулою C6H14), відрізняються максимально можливою кількістю атомів водню. Інша характерна риса елементів класу – прості зв’язки молекул: 4 атоми водню пов’язані з 1 атомом вуглецю лініями з’єднання з верхнім кутом геометричної фігури тетраедр; з’єднанням між чотирма атомами водню є неполярний зв’язок. Обидва типи зв’язку високоміцні, наслідком є низька хімічна активність речовини.
При двох основних типах зв’язку молекули формули гексану можуть мати п’ять варіантів структури або розташування атомів за фіксованим «каркасом». Відповідно до цього показника виділяють п’ять ізомерів гексану:
* н-Гексан (формула реактиву – CH3CH2CH2CH2CH2CH3);
* 2-Метилпентан, або ізогексан (структура молекули – CH3CH(CH3)CH2CH2CH3);
* 3-Метилпентан (поєднання атомів CH3CH2CH(CH3)CH2CH3);
* 2,3-Диметилбутан, або діізопропіл (формула CH3CH(CH3)CH(CH3)CH3);
* 2,2-Диметилбутан (інша назва – неогексан: CH3C(CH3)2CH2CH3).
Кожен із виділених ізомерів гексану має свою температуру плавлення та кипіння. Найбільш низькою температурою кипіння відрізняється 2-метілпетан (-153,7 градуса Цельсія), а найвищу температуру кипіння має н-гексан (68,7 градусів). Тип ізомеру визначає сферу застосування реактиву, тому для отримання бажаного результату необхідний точний облік його відповідності галузі виробництва або аналізу матеріалів.
Формула ізомерів
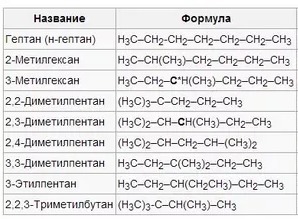
Ізомери гептану
Гептан має 9 ізомерів, їх структурні формули та номенклатура:
Ізомери октану
Октан має 18 структурних ізомерів