Зміст
Азотна кислота HNO 3 є однією з найважливіших неорганічних кислот. Будучи ключовим інгредієнтом добрив, це одна з найпоширеніших хімічних сировинних матеріалів у світі. За словами аналітиків Fortune Business Insights, попит на нього продовжить зростати в найближчі десятиліття.
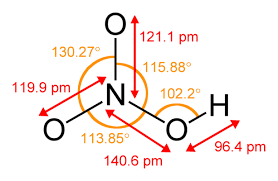
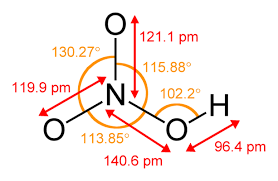
Азотна кислота – властивості
Найдавніші згадки про азотну кислоту датуються 14 століттям і першими сміливими алхімічними спробами. Потім його використовували для виробництва царська горілка ( aqua regia ), тобто розчин, здатний розчиняти золото і платину. Насправді HNO 3 є сильно корозійною та хімічно дуже активною речовиною.
Азотна кислота (V) — безбарвна рідина з надзвичайно різким запахом і корозійними властивостями . При тривалому зберіганні під впливом температури змінює колір на жовтий внаслідок самовільного розкладання на оксиди азоту і воду. Він легко реагує з багатьма речовинами, а при розчиненні у воді виділяє тепло. Значна частина реакцій за її участю майже вибухова.
Як сама азотна кислота, так і її солі є сильними окислювачами. Цим фактом пояснюється бурхлива реакція з металами, в результаті якої виділяється водень. Однак неактивні метали і деякі неметали, наприклад сірка, фосфор і вуглець у вигляді графіту, також піддаються реакціям з HNO 3 . Останні окислюються з утворенням кислот.
Концентрована азотна кислота є дуже небезпечною речовиною. При попаданні на шкіру викликає сильні опіки і навіть некроз. У вигляді парів вона вражає дихальні шляхи, що призводить до набряків і пневмонії. Випадкове споживання HNO 3 може призвести до смерті внаслідок перфорації шлунка або кишечника.

Як утворюється азотна (V) кислота?
Азотну кислоту можна отримати реакцією діоксиду азоту з водою. Для комерційних цілей основним способом виробництва є т.зв процес Оствальда. Мова йде про каталітичне окислення аміаку до оксиду азоту, яке за допомогою спеціальних абсорбційних веж дозволяє отримати концентровану кислоту HNO 3 . Для комерційних цілей найбільш бажаною є концентрація 65–68% .
В лабораторних умовах альтернативним способом виробництва є реакція нітрату калію з сірчаною кислотою, утворюючи чисту азотну (V) кислоту.
Використання азотної кислоти
В результаті нейтралізації азотної кислоти аміаком утворюється аміачна селітра – найважливіший компонент мінеральних добрив, що використовуються в усьому світі. Забезпечує культурні та декоративні рослини необхідним для росту азотом у високих, добре засвоюваних дозах. Крім того, кислоту HNO 3 можна використовувати в садівництві для підкислення субстрату.
У хімічній промисловості азотна кислота (V) є перш за все прекурсором для отримання органічних сполук азоту, наприклад нітробензолів. У поєднанні з ароматичними сполуками він дає речовини, які використовуються у виробництві вибухових речовин, наприклад тротил (TNT) або нітрогліцерин.
Іншим важливим застосуванням є ракетне паливо. Для цього готують суміш HNO3 , чотириокису азоту та пероксиду водню, також відому як червона димляча азотна кислота . Його використання в космічній промисловості обумовлено можливістю ефективного зберігання сировини.
Потенціал азотної кислоти у виробництві пластмас також заслуговує на увагу . Завдяки ініційованому ним окисленню утворюється адипінова кислота, яка надалі використовується для виробництва синтетичних волокон, наприклад нейлону.
Інші більш нішеві використання азотної кислоти включають:
- виробництво органічних барвників і лаків;
- фармацевтична промисловість;
- виробництво фунгіцидів;
- очищення та травлення металевих поверхонь;
- рафінування дорогоцінних металів в ювелірній промисловості;
- штучне старіння деревини для отримання потрібного відтінку;
- виробництво миючих засобів для побутового використання;
- виявлення слідів металів у лабораторно перевірених речовинах.
Концентрована азотна кислота та запобіжні заходи
Через вибуховий характер реакцій і отриманих сумішей, а також виняткову небезпеку для здоров’я, азотна кислота вимагає особливої обережності під час зберігання та поводження. Згідно з правилами ADR щодо перевезення небезпечних вантажів, вони повинні транспортуватися в алюмінієвих цистернах або автоцистернах з відповідним маркуванням.
Для зберігання азотної кислоти використовують спеціальні ємності, стійкі до її дії. Вони повинні бути належним чином закриті та зберігатися подалі від сонячного світла при температурі нижче 20°C. Поруч не повинно бути металів і легкозаймистих речовин. Саме приміщення повинно добре провітрюватися.
Концентрована азотна кислота також вимагає використання засобів індивідуального захисту при роботі з сировиною. Кожен, хто контактує з кислотою, повинен носити респіратор, захисні окуляри та кислотостійкий одяг і рукавички. Після роботи бажано ретельно вимити руки та обличчя, нанести на шкіру захисний крем.
Як азотна кислота (V) впливає на навколишнє середовище?
Випадкове потрапляння HNO 3 у навколишнє середовище становить загрозу для людей, тварин і рослин. Тому необхідно за будь-яку ціну запобігти потраплянню кислоти в поверхневі та підземні води. Будь-які витоки необхідно негайно усунути абсорбуючими матеріалами або відкачати.
Азотна кислота є сировиною, яка широко використовується і відіграє ключову роль у промисловості штучних добрив, вибухових речовин і синтетичних матеріалів. Однак переваги, пов’язані з його використанням, не можуть переважити потенційні ризики. Відповідальне дотримання чинних норм є найкращою формою запобігання нещасним випадкам, які загрожують життю.